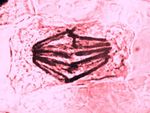
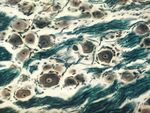
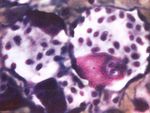
Barvící metody využívají různé afinity buněčných složek k přirozeným nebo umělým barvivům. Umožňují barevně odlišit základní součásti buněk (např. jádro, cytoplasmu) a tkání (např. epitel, vazivo, svalovinu).
Biologické objekty se většinou barví po fixaci roztokem formaldehydu, často s příměsí různých látek (pufrovací soli, kys. pikrová aj.). Fixační látky se z objektu odstraní vypíráním ve vodě, objekt se odvodní alkoholem a ten se nakonec nahradí rozpouštědlem parafínu (např. xylenem). Vzorek prosycený ztekuceným parafínem je zalit do tzv. parafínového bloku. Tvrdší tkáně mohou být zality také do celoidinu, nebo do epoxidových pryskyřic apod. Moderní zalévací média na bázi epoxidových pryskyřic umožňují zhotovení velmi tenkých řezů s lepším rozlišením buněčných detailů. Z bloků se zhotovují pomocí mikrotomů řezy 5-10 um, které se umístí na podložní skla. Parafín se z nich odstraní xylenem a přes sestupnou koncentraci alkoholů se řezy převedou do vody. Na podložním skle zůstává odparafínovaný, zavodněný tkáňový řez připravený pro vlastní barvení.
Barviva s dělí na bázická, která se vážou na kyselé (bazofilní) struktury buňky (jádro, jadérko) a kyselá, znázorňující cytoplasmu a jiné acidofilní komponenty. Nejužívanější bázické barvivo je hematoxylin (H), v praxi často kombinovaný s kyselým barvivem eosinem (E). Tato základní přehledná barvící metoda (HE) znázorňuje bazofilní součásti buněk (jádra) modře, modrofialově až černě, zatímco acidofilní součásti (cytoplasma) v různých stupních růžové až červené.
Selektivní barvící metody umožňují barevné odlišení různých tkáňových komponent. Vazivo lze zbarvit mnoha postupy, z nichž nejužívanější jsou trichromové metody, spočívající v kombinaci barvení hematoxylinem, ponceau-fuchsinem a světlou zelení (anilinovou modří či oranží G) a tradiční metoda AZAN. Elastická vlákna se prokazují např. orceinem, resorcinfuchsinem a aldehydovým fuchsinem. Specifické vazby barviv na některé buněčné struktury využívají speciální cytologické metody, např. barvení nukleových kyselin metylovou zelení a pyroninem, mitochondrií alizarinem a krystalovou violetí. Metody neurohistologické využívají kupř. barvení Nisslovy substance v tělech nervových buněk krystalovou violetí nebo thioninem. K průkazu glykogenu v buňkách slouží empirické barvení Bestovým karmínem nebo histochemická reakce PAS. Zvláštními metodami je možno ve tkáních prokázat látky mukopolysacharidové povahy, mukoproteiny a glykoproteiny, dále také tukové (barvení sudanovými barvivy nebo olejovou červení), různé pigmenty, anorganické látky apod. Přesnější buněčnou nebo látkovou topiku chemických látek a sloučenin umožňují metody cytohistochemické.
Široká škála různých barvících metod je základním prostředkem morfologického výzkumu v botanice, zoologii a lékařství. Je rovněž základem diagnostických (bioptických), histologických a cytologických vyšetřovacích metod v lékařství, nepostradatelných v léčebně diagnostické praxi klinik a různých zdravotnických zařízení.
Fotogalerie